㈠方法簡介
采用磺基水楊酸鐵褪色光度法測定時,在pH4.5的HAc-NH4Ac介質中,鐵(III)-磺基水楊酸生成紫紅色配合物,當加入檸檬酸標準溶液后,使紫紅色配合物褪至橙紅。在10~15min內,褪色液的ΔA較大而且穩定。在20℃~30℃溫度時,△A基本穩定。因而可在常溫下,于470nm波長處,根據其ΔA值,測定檸檬酸及其鹽的含量[5]。
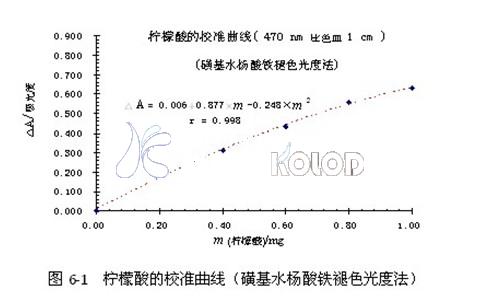
文獻[5]認為:褪色吸光度△A之值與檸檬酸的質量(m/mg)在一定范圍內成線性關系。筆者對原數據進行處理,兩者的關系式應為:△A=0.006+0.877×m檸檬酸-0.248×m2檸檬酸
鍍液里的還原性物質,用H2O2氧化避免其干擾。
㈡儀器
⑴分光光度計。
⑵比色皿:1cm。
㈢試劑
⑴H2O2:30%。
⑵HClO4溶液:0.025mol/L。
⑶檸檬酸標準儲備液:10g/L,稱2.5000g檸檬酸,用水溶解并定容至250mL。
⑷檸檬酸標準工作液:1g/L,取上述檸檬酸標準儲備液10.0mL,加水定容至100mL。
⑸Fe3+標準溶液:0.01mol/L,稱4.8220gNH4Fe(SO4)2·12H2O,用0.025mol/LHClO4溶解,加水定容至1000mL。
⑹磺基水楊酸溶液:0.01mol/L,稱磺基水楊酸2.5420g,用0.025mol/LHClO4溶解,加水定容至1000mL。
⑺HAc-NH4Ac緩沖溶液:取冰HAc28mL,加500mL水稀釋,然后用濃氨水調溶液pH至4.5為止。
㈣校準曲線的制作
⑴在6支25mL比色管依次加入1.0mLFe(III)溶液,4.0mL磺基水楊酸溶液,4.0mL
HAc-NH4Ac緩沖溶液。將其中1支25mL比色管,以水定容至刻度。
⑵在余下的5支25mL比色管中,依次加入1g/L的檸檬酸工作液的mL數各為:0.2、0.4、0.6、0.8、1.0后,以水定容至刻度。
⑶10min后,在470nm處,用1cm比色皿,分別以后5支25mL比色管的褪色液為參比,分別測定出第一支比色管(未加入檸檬酸)溶液的吸光度,即為后5支25mL比色管中褪色液的褪色吸光度△A之值。
⑷以褪色吸光度△A之值為縱坐標,檸檬酸的質量(m/mg)為橫坐標,繪制校準曲線。
如圖6-1。
⑴在10mL燒杯中,加入鍍液1.0mL(V1/mL),蓋上表面皿后,向燒杯中緩緩滴加1~2mL30%的H2O2溶液,放置片刻后,定量轉移到25mL容量瓶(V/mL)中,以水定容后搖勻。
⑵取2支25mL比色管,在1支比色管中,加入稀釋液5mL(V2/mL,控制加入的檸檬酸及其鹽的質量在0.2~1.0mg之間)。
⑶在2支25mL比色管中,依次加入Fe(III)溶液1.0mL,磺基水楊酸溶液4.0mL,4.0mLHAc-NH4Ac緩沖溶液。以水定容至刻度后搖勻。
⑷10min后,在470nm處,用1cm比色皿,以加入稀釋液比色管的褪色溶液為參比,測定未加稀釋液比色管溶液的吸光度,從而測得褪色吸光度△A之值。
⑸以測得的褪色吸光度△A之值,在“圖6-1檸檬酸的校準曲線(磺基水楊酸鐵褪色光度法)”上,查出相應的檸檬酸的質量(m/mg)。
㈥計算
式中ρ檸檬酸銨—鍍液中檸檬酸銨[(NH4)3C6H5O7]的質量濃度,g/L;
243.2—檸檬酸銨[(NH4)3C6H5O7]的相對分子量,1;
192.1—檸檬酸(C6H8O7)的相對分子量,1;
m檸檬酸—顯色液中檸檬酸的質量,mg;
V2—吸取稀釋液的體積,mL;
V1—鍍液的取樣體積,mL;
V—容量瓶的標稱容積,mL。